Tartalomjegyzék
A tejszintézis molekuláris biológiája
Dr. Kun Judit Gabriella
Az emlőmirigy mikroszkópos szerkezete
Az érett alveolusban a tejtermelő sejtek (további elnevezések: alveoláris sejtek, epitélsejtek, epiteliális sejtek, laktociták, szekretoros sejtek) egyetlen sejtréteget alkotnak, amelyek körülveszik az alveolus üregét. Az alveolusokat és a kis tejcsatornákat a kontraktilis, mioepiteliális sejtek hálózata veszi körül. Az alveolusok és tejcsatornák egy kötőszövetes stromába ágyazódnak be.
Bár kétségkívül az emlőmirigy epiteliális sejtjei felelősek az anyatej összetevőinek előállításáért és az alveolusok üregébe juttatásáért, a tejtermelés folyamatába más sejttípusok is bekapcsolódnak. A mioepiteliális sejtek a tejleadásért felelősek, a stromában pedig további sejttípusok – fibroblasztok, zsírsejtek, plazmasejtek – valamint vérerek is jelen vannak. A laktáció során a véráramlás jelentősen megnő az emlőben, hogy a tejszintézishez szükséges nagy mennyiségű alapanyagot biztosítsa. A stroma sejtjei részt vesznek az emlőmirigy fejlődésében és a tej szekréciójában is. A fibroblasztok és zsírsejtek növekedési faktorok, mint például a hepatikus növekedési faktor és az IGF-1 forrásai, és valószínűleg ezek termelik a tej zsírszintéziséhez szükséges lipoprotein lipáz enzimet is (Neville, 1998). A laktáció során B limfociták költöznek be az emlőmirigybe, plazmasejtekké differenciálódnak, és letelepednek az intersticiális térben, ahol ellenanyagokat termelnek, amelyek végül bekerülnek a tejbe (Roux, 1977). Így az alveoláris epitéliumra úgy tekinthetünk, mint sokféle sejt és szövet aktivitásának koordinátorára, aminek eredménye az anyatej előállítása.
A tej bioszintézise az alveoláris epitél- (hám-) sejtekben történik. Az emlőmirigy epitéliuma őssejteket és magasan differenciált szekretoros sejteket tartalmaz az alveolusokban. Az őssejteket a növekedési hormon és az inzulin ösztökéli szekretoros aktivitásra; a prolaktin erősíti az inzulin hatását.
Az acinusok és a kis tejcsatornák sejtjei aktívan részt vesznek a tejtermelésben, amit a prolaktin serkent. A tejtermelő sejteknek kuboidális (kocka) alakjuk van, ami a tejszintézis kezdete előtt henger alakúvá változik, párhuzamosan a vízfelvételük megnövekedésével. A nyugvó sejtekben a sejtmag bazálisan helyezkedik el, de a tejszintézis megindulásakor a sejt csúcsához vándorol. Az aktívan szintetizáló sejtekben bőségesen található durva felszínű endoplazmás retikulum (dER) és Golgi készülék a sejtmag felett, amelyet számos mitokondrium vesz körül. Az apikális felszínen mikrobolyhok láthatók, a bazális membrán pedig jelentősen felgyűrődik (bazális csíkolat, bazális labirintus), hogy felületet biztosítson az intenzív anyagtranszportnak a véráramból a sejtbe. A citoplazmában zsírcseppek láthatók, amelyek a membránnál kidudorodnak. Fehérjék, laktóz, kálcium, foszfát és citrát csomagolódnak szekréciós vezikulumokba, majd exocitózissal az alveolus üregébe ürülnek. A hámsejtek bazális felszíne mentén mindig megtalálható a sejtek által termelt réteg, az alaphártya vagy alaplemez (lamina basalis), amely fehérjéket, glikoproteideket, proteoglikánokat és glikozamino-glikánokat tartalmaz. Az alaphártya a kapilláris endotéliumsejtek bazális pólusán is jelen van, ezért a vérrel érkező molekuláknak mindkét rétegen át kell hatolniuk ahhoz, hogy bejussanak a tejtermelő sejtekbe, illetve az anyatejbe (Lawrence, 2011).
A tejtermelés szabályozása
A várandósság alatt a tejmirigyben nagy horderejű változások mennek végbe, amelyeknek eredménye egy olyan alveoláris hám, amely képes a tejspecifikus összetevők szintézisére (szekretoros differenciálódás). A szekretoros differenciálódásban nélkülözhetetlen szerepük van a várandósság alatt magasabb koncentrációban jelenlévő hormonoknak, mint amilyen a humán placentáris laktogén (HPL), ösztrogén, progeszteron, prolaktin, és a támogató metabolikus hormonok: inzulin, kortizol, pajzsmirigyhormonok, növekedési hormon (Pang, 2007).
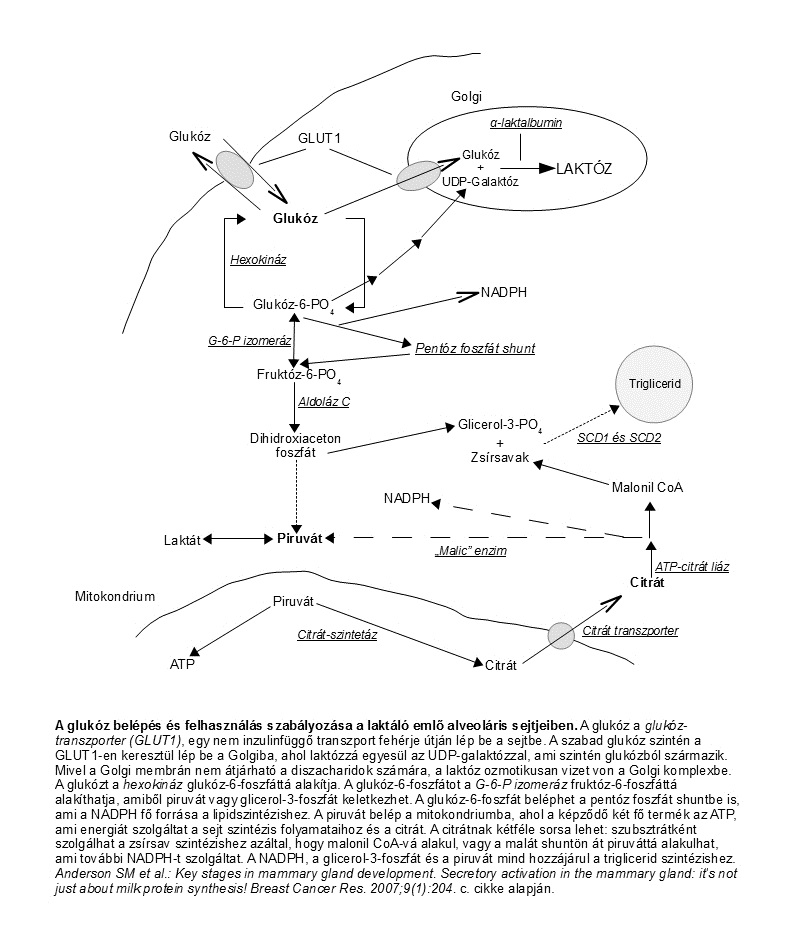
A prolaktin, amely a tejtermelést serkentő legfőbb hormon, a terminusra a nem-terhes szint 10‑20‑szorosára emelkedik. A magas keringő prolaktin koncentráció ellenére a várandósság alatt nem indul be a bőséges tejtermelés. Ennek oka a gátló hormonok – elsősorban a progeszteron – jelenléte. A magas progeszteron-szint gátolja a prolaktin serkentő hatását a kazein mRNS átírásra. A magas ösztrogénszint gátolja a prolaktin bejutását a tejtermelő sejtekbe, és a késő terhességben a prolaktin receptorokat a HPL foglalja el (Lawrence, 2011). Szüléskor, a placenta kiürülésével a gátló hormonok koncentrációja leesik, és a prolaktin – felszabadulva a gátlás alól – ki tudja fejteni tejtermelést serkentő hatását az alveoláris sejteken. A prolaktin elősegíti a kazein mRNS átírását és serkenti az α-laktalbumin szintézisét, ami a laktóz-szintetáz enzim esszenciális kofaktora. A prolaktin fokozza a lipoprotein lipáz aktivitását is. A prolaktin ezenkívül szabályozza a GLUT1, egy nem inzulinfüggő glukóz transzporter fehérje génexpresszióját is. A GLUT1 a fő glukóz transzporter a bazális membránban és a Golgi komplexben is (Anderson, 2007).
A szekretoros aktiválódás, aminek végeredménye a bőséges tejmennyiség megjelenése (tejbelövellés) tehát a placenta megszületésével és a progeszteron-szint drasztikus csökkenésével kezdődik. A progeszteron-szint leesése nélkül a szekretoros aktiválódás és a tejbelövellés nem következik be (Hurst, 2007). A tejtermelés egyik kulcs momentuma a laktóz szintézis megindulása.
A glukózból és UDP-galaktózból történő laktózszintézis egyedülálló a laktocitákban. A reakciót a laktóz-szintetáz katalizálja, ami a β-1,4 galaktozil-transzferáz és az α-laktalbumin kombinációja a Golgi komplexben. Az α-laktalbumin mennyisége behatárolja a reakciót, ezért a várandósság alatti nagyon alacsony koncentrációja megelőzi, hogy a laktóz szintézis túl korán beinduljon.
A laktóz-szintetáz reakcióban a Michaelis konstans (Km)1) a glukóz vonatkozásában millimólos (mmol) nagyságrendű, ezért nagyon fontos, hogy az alveoláris sejtekben a glukóz koncentráció a szokásosnál magasabb legyen. A kutatási eredmények azt mutatják, hogy ez valóban így is van: a laktáló alveoláris sejt egyik jellegzetessége, hogy citoplazmájában a glukóz koncentráció igen magas. A szekretoros aktiválódás időszakában a tej glukóz koncentrációja – amit a sejtek citoplazmájának glukóz koncentrációjával azonosnak tartanak – mintegy 4,5-szeresére nő (Allen, 1991). A glukóz szint megemelkedésében nélkülözhetetlen szerepe van a GLUT1 tarnszportfehérjének, amely elősegíti a glukóz bejutását a tejtermelő sejtbe (és a Golgi készülékbe is). A prolaktin a GLUT1 génexpressziójának fokozásával ezen a ponton is serkenti a laktózszintézist, valamint a glukózból képződő többi tejalkotó szintézisét is. (1. ábra) Mivel a laktóz csak glukózból szintetizálódik, a teljes laktáció idején az anya glukóz felhasználása 30%-kal megnő.
A sejtben a glukóz egy része galaktózzá alakul, majd mindkettő belép a Golgi komplexbe. Mivel a Golgi membránja nem engedi át a laktózt, a cukor ozmotikusan aktívvá válik, és vizet von a Golgi készülékbe, illetve a róla leváló vezikulumokba. A laktóz által bevont víz végül a tej részévé válik, ilyen módon a laktózszintézis közvetlen összefüggésben van a tej mennyiségével (Anderson, 2007).
A szekretoros aktiválódással együtt jár, hogy az alveoláris sejtek közötti, korábban tág rések összezáródnak, és a sejteket sejtkapcsoló struktúrák, ún. tight junction-ok kapcsolják össze. Az epitél réteg szoros összezáródása után a két sejt közötti résben már csak korlátozottan tudnak átjutni a különböző molekulák és sejtek. Ilyen módon az alveoláris sejtek rétege megakadályozza, hogy a különböző anyagok szabadon átáramolhassanak a vérből a tejbe (Nguyen, 2001; Neville, 1991). Az összezáródás megtörténte azonnal észlelhető a tej összetételének megváltozásában: a Na2+ és Cl- koncentrációja lecsökken, a laktóz szint pedig megnő (Kulski, 1981; Neville, 1991). Ennek a határrétegnek a tulajdonságai, valamint az epitélsejtek polarizált természete (azaz, hogy a bazális és apikális membrán funkciói drasztikusan különböznek egymástól, valamint a sejtalkotók szintén polarizáltan helyezkednek el) alapvető jelentőségű a tejszintézis módja és a tej összetétele szempontjából.
A szekretoros aktiválódás folyamatának beindulása nem függ a csecsemő szopásától, de a 3-4. posztpartum nap után a tejtermelés sebessége csökken, ha a tejet nem ürítik ki rendszeresen az emlőből.
 A már megindult laktáció időszakában a tejtermelést helyi mechanizmusok szabályozzák (autokrin kontroll), és nem függ a vér prolaktin koncentrációjától (Cox, 1996). Amikor az alveolus tele van tejjel, és az epiteliális sejtréteg ellapul, az alveoláris sejtek nem veszik fel a prolaktint, így az nem tudja kifejteni tejtermelést serkentő hatását. Ilyenkor a legalacsonyabb a tejtermelés sebessége, amihez egy „feedback inhibitor of lactation” (FIL) nevű gátló fehérjének a tejben való felszaporodása is hozzájárul (Wilde, 1995; Cox, 1996). A laktáció során a tejtermelés sebességét a kiürítés mértéke határozza meg, és a tejtermelés folyamatosságának fenntartásában, valamint a tejmennyiség meghatározásában a legfontosabb tényező az emlő kiürítése (Daly, 1992; Daly, 1993; Daly, 1996; Cregan, 2002).
A már megindult laktáció időszakában a tejtermelést helyi mechanizmusok szabályozzák (autokrin kontroll), és nem függ a vér prolaktin koncentrációjától (Cox, 1996). Amikor az alveolus tele van tejjel, és az epiteliális sejtréteg ellapul, az alveoláris sejtek nem veszik fel a prolaktint, így az nem tudja kifejteni tejtermelést serkentő hatását. Ilyenkor a legalacsonyabb a tejtermelés sebessége, amihez egy „feedback inhibitor of lactation” (FIL) nevű gátló fehérjének a tejben való felszaporodása is hozzájárul (Wilde, 1995; Cox, 1996). A laktáció során a tejtermelés sebességét a kiürítés mértéke határozza meg, és a tejtermelés folyamatosságának fenntartásában, valamint a tejmennyiség meghatározásában a legfontosabb tényező az emlő kiürítése (Daly, 1992; Daly, 1993; Daly, 1996; Cregan, 2002).
A tejtermelés autokrin szabályozásáról megismert alapelveket Cox és munkatársai az alábbi pontokban foglalták össze:
- Az anyai vér prolaktin koncentrációja nem befolyásolja a tejtermelést.
- A csecsemők szabályozzák a saját tejfogyasztásukat (az nem az elérhető tejmennyiségtől függ).
- A tejtermelés sebességének szabályozása az egyes emlőkön belül történik (egymástól függetlenül).
- A tejtermelés sebessége összefügg az emlő kiürítésének mértékével.
- Az emlő tejtárolási kapacitása a nők között nagy változatosságot mutat.
- Az emlő tejtárolási kapacitása meghatározza, hogy az anyának mekkora szabadsága van abban, hogy milyen gyakran szoptatja meg a gyermekét (kisebb tárolókapacitású anyáknak gyakrabban kell szoptatni).
- A tejtermelés szabályozása korlátozhatja a prolaktin kötődését és bejutását a sejtbe.
- A tej zsírtartalma egyre nő, ahogy az emlő ürül, így a tej zsírtartalma közvetlen összefüggésben van az emlő telítettségének mértékével (Cox, 1998).
A tejszintézis folyamata
A tejösszetevők alapanyagai a kapillárisok falán keresztül kilépnek a vérből a kapillárisok és az epitélsejtek közötti extracelluláris folyadékba. Innen az epiteliális sejtek a bazolaterális membránon keresztül veszik fel azokat. Miután bekerültek a sejtbe, a prekurzor molekulák belépnek a megfelelő biokémiai folyamatba. Néhány előregyártott fehérje, mint például az immunglobulinok, érintetlenül utaznak keresztül a sejt testén.
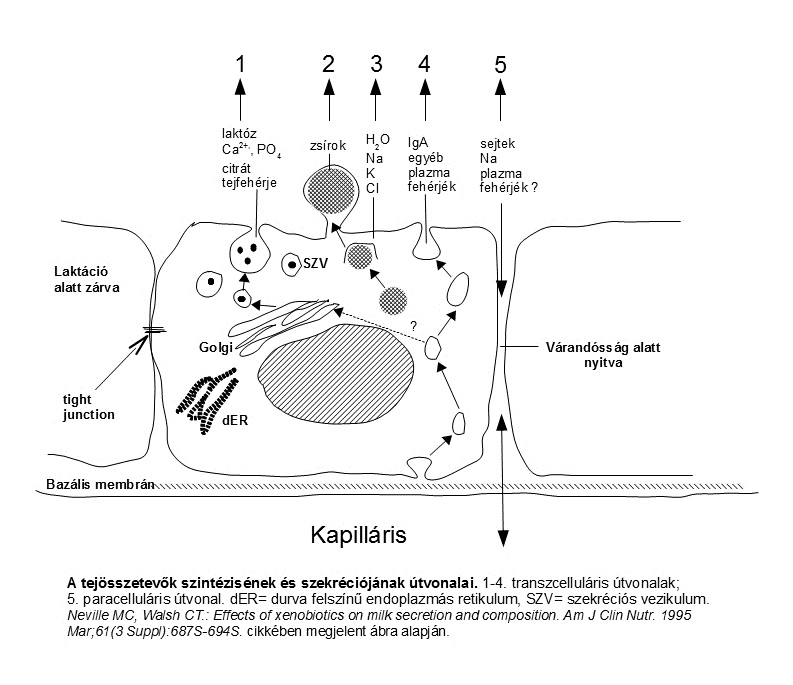
Az alapanyagok felvételének, feldolgozásának és az összetevők szekréciójának öt különböző útvonalát különböztetik meg az alveoláris sejtekben. (2. ábra) Ezek közül négy a sejten keresztül vezet (transzcelluláris), az ötödik a paracelluláris út, a két sejt közötti teret használja ki: (Neville, 1998)
- Tejfehérjék és laktóz exocitózisa a Golgi készülékből származó szekretoros vezikulumokban
- Tejzsír szekréció zsírcseppek útján
- Ionok és víz szekréciója az apikális membránon át
- Immunglobulinok endocitózisa és exocitózisa
- Paracelluláris útvonal plazma alkotóelemek és fehérvérsejtek számára
1. Exocitózis
A tej vizes fázisának legtöbb komponense exocitózis útján (1. útvonal) szecernálódik. Az aminosavak több specifikus transzportrendszer segítségével jutnak be a bazális membránon keresztül a sejtbe. A sejt belsejében az aminosavak a dER riboszómáihoz szállítódnak, ahol kovalens kötések kialakításával hozzák létre a megfelelő fehérjéket. A dER-ben szintetizálódó fehérjék egy része a tej alkotóeleme, más része membránhoz kötött fehérje – pl. membránhoz kötött enzimek, sej-sejt kapcsolatokban résztvevő fehérjék. A riboszómákon szintetizált fehérjék a dER lumenébe kerülnek, ahol a szignál szekvenciák lehasadnak, és a fehérjemolekulák vezikulumokba csomagolódnak. A vezikulumok a Golgi készülékbe szállítják a fehérjéket, ahol szénhidrátok, foszfát vagy más csoportok hozzáadása történik, majd szekretoros vezikulumokba csomagolódnak.
A kazein micellumok formájában választódik ki, amiknek a kialakítása a Golgi készülékben kezdődik a kazein molekulák összesűrűsödésével, majd – valószínűleg a szekréciós vezikulumokban – kálcium adódik hozzájuk, aminek következtében az érett micellumok elegendően denzzé válnak ahhoz, hogy elektronmikroszkóppal láthatókká váljanak.
A tejfehérjék elsöprő többsége csak a tejben megtalálható, a természetben sehol máshol nem fordul elő. Az endoplazmatikus retikulumhoz nem kötött, szabad riboszómákon történik a sejtben maradó fehérjék – pl. strukturális fehérjék, enzimek és más sejtfehérjék – szintézise. A fehérjék szintézisén túl a tejtermelő sejt a Golgi készülékben laktózt is szintetizál (ld. fentebb). A laktóz ozmotikus aktivitása miatt a transz-Golgi és a szekretoros vezikulumok mikroszkóp alatt is láthatóan megduzzadnak, ami egyedülállóan jellemző az aktív tejtermelő sejtek kinézetére. A Golgi készülék rendkívül fontos a tejösszetevők szintézisében, minthogy részt vesz a tejfehérjékkel kapcsolatos műveletekben, a laktóz szintézisben és a víz ozmotikus bevonásában is.
A tej vizes fázisának többi alkotóeleme közül a legtöbb – mint a citrát, nukleotidok, kálcium, foszfát, valamint valószínűleg a monovalens ionok és a glukóz is – szintén szekretoros vezikulumokban szállítódik. Ugyanakkor a szekretoros sejt apikális membránjában vannak monovalnes ionok és glukóz szállítására alkalmas transzporter fehérjék is, illetve koncentráció különbségen alapuló közvetlen membrán transzport is előfordul az apikális membránon keresztül.
A szekretoros vezikulumok a sejt apikális felszínéhez vándorolnak, ahol mebránjuk egyesül a plazmamembránnal, és tartalmuk az alveolus lumenébe ürül (exocitózis). A vizsgálatok szerint, az exocitózis folyamatos a szekréció megindulása után, azaz az epiteliális sejtben nem tárolódnak a szekrécióra szánt termékek.
2. Lipidek
A tej zsírtartalmának több mint 98%-a triglicerid. A trigliceridek az alevoláris sejtek sima felszínű endoplazmás retikulumában (sER) szintetizálódnak prekurzor zsírsavakból és glicerolból. A prekurzorok a bazolaterális membránon keresztül lépnek be a sejtbe, vagy de novo szintézis útján keletkeznek glukózból (1. ábra). A képződő trigliceridek kis cseppecskéket alkotnak, amelyek egyre növekvő lipid cseppekké állnak össze, ahogy az apikális membrán felé haladnak. A nagy lipidcseppek egyre jobban kidudorodnak az apikális membránon, míg végül kiszakadnak, és bekerülnek az alveolus lumenébe, magukkal ragadva a sejtmembrán egy részét, és alkalmanként némi citoplazmát is. Így jönnek létre a tejzsír golyócskák (globulusok), amelyeket membrán vesz körül. (A sejt belsejében a lipidcseppeket nem veszi körül membrán, míg a tejben lévő globulusokat igen.)
A tejzsír globulusokat körülvevő membránnak két funkciója van: egyrészt ez a foszfolipidek és a koleszterin elsődleges forrása a szoptatott csecsemő számára, másrészt megakadályozza, hogy a zsír összeálljon, ami nehézzé tenné a kiürítést. A vaj köpülésekor az ütések hatására a membrán leválik a zsírcseppekről, és lehetővé válik, hogy a zsírcseppek összeálljanak (Neville, 1998).
3. Transzport az apikális membránon keresztül
Az apikális útvonal funkciója még nem teljesen tisztázott, mivel a tej vizes fázisának összetételét a Golgiban és a szekretoros vezikulumokban zajló folyamatok meghatározzák. Annyi biztos, hogy az apikális útvonal néhány kis molekulára korlátozódik (Neville, 1998). A nátrium, kálium, klorid, magnézium, kálcium, foszfát, szulfát és citrát mindkét irányban átmegy az alveoláris sejt membránján. A víz számára szintén mindkét irányban átjárható a membrán.
Az emberi tej különbözik más fajok tejétől abban, hogy magas benne a laktóz, és alacsony a monovalens ionok koncentrációja. Mivel a tej izozmotikus a palzmával, minél magasabb a laktóz koncentrációja, annál alacsonyabb az ionoké. Feltételezik, hogy a kálium és a nátrium intracelluláris koncentrációját aktív pumpák tartják magasan, illetve alacsonyan (Lawrence, 2011).
4. Intersticiális molekulák transzcitózisa
Az emlőmirigy epitéliumán intakt fehérjék képesek keresztüljutni vagy transzcitózissal vagy a paracelluláris útvonalon. A laktáció időszakában csak a transzcitózis járható út. Transzcitózissal kerülnek a tejbe például az immunglobulinok. Az immunglobulinokat – amely leginkább IgA – az intersticiális térben lévő plazmasejtek szintetizálják, de a test más részeiből is bekerülhetnek a tejbe.
A fehérjék az alveoláris sejt bazális felszínén lévő immunglobulin receptorhoz kötődnek, majd az egész IgA-receptor-komplex endocitózissal bekerül a sejtbe. Az endocitotikus vagy transzport vezikulum átszállítja a komplexet az apikális felszínhez. A transzport vezikulumok menet közben nem lépnek interakcióba sem a Golgi készülékkel, sem a szekretoros vezikulumokkal, sem a lipidcseppekkel. Az apikális membránnál a transzport vezikulum mebránja egyesül az apikális membrán belső felszínével, a receptor extracelluláris része lemetsződik, és az IgA-val együtt kiszabadul az alveolus lumenébe. A levágott receptor rész szekretoros komponens néven ismert, így a szecernált termék a szekretoros IgA (sIgA).
A plazmából származó sokféle fehérje, hormon és növekedési hormon hasonló módon jut be az anyatejbe (Neville, 1998).
5. A paracelluláris útvonal
A paracelluláris útvonal lehetővé teszi, hogy az anyagok az epiteliális sejtek között – és nem rajtuk keresztül – bejussanak az alveolus üregébe. A laktáció idején azonban ez az út még kis molekulák számára is átjárhatatlan, mivel a tömítésszerű tight junction-ok (zonula occludens) szorosan egymáshoz horgonyozzák az alveoláris sejteket. Ennek ellenére az immunsejtek úgy tűnik, át tudnak mászni (diapedesis) a sejtek között és elérik a tejet, de a sejtkapcsoló strukturák szorosan összezáródnak mögöttük, így a sejtek között nem marad tartós rés. Az anyatejben mintegy 4000 sejt található milliliterenként, amelyeket fehérvérsejtekként azonosítottak. Legnagyobb számban a makrofágok fordulnak elő, amelyek lizozimet és laktoferrint szecernálnak, de rajtuk kívül limfociták, neutrofil leukociták és hámsejtek szintén jelen vannak. A limfociták IgA-t és interferont termelnek (Lawrence, 2011).
A várandósság alatt, masztitisz idején és az involúció után a tight junction-ok áteresztőkké válnak, és az intersticiális tér összetevői akadálytalanul bejutnak a tejbe. Ugyanekkor a tej alkotórészei is bekerülhetnek a plazmába. Ezekben az időszakokban hasznos a nagyobb áteresztőképesség, mert a szekréciós termékek elhagyhatják a tejmirigyet, a gyulladásos sejtek és védőfaktorok be tudnak jutni az alveolus üregébe, az elpusztult tejtermelő sejtek maradványai pedig ki tudnak tisztulni az emlőből. Amikor a paracelluláris útvonal szabadon átjárható, a tejben magassá válik a nátrium és a klorid koncentráció. A sósabb tejet a csecsemő elutasíthatja (Neville, 1998).
A tejtermelő sejtek szintetikus aktivitása
Az egy alveoluson belüli sejtek szintetikus aktivitása szinkronban van egymással. Miközben néhány alveolusban a sejtek tele vannak lipidcseppekkel és szekretoros vezikulumokkal, más alveolusokban hiányoznak ezek a struktúrák a sejtekből.
A szekretoros aktivitás két fázisból áll:
- Intracelluláris szekretoros struktúrák – mint például lipidcseppek és szekretoros vezikulumok – létrejötte, miközben az alveoláris sejtek egyre jobban felpuffadnak és kifeszülnek. A sejtek magasak, hengeralakúak.
- A termékek kiürítése a lumenbe. A sejtek kocka alakúvá válnak, a lumen megtelik tejjel. A sejten belüli szintézis ezalatt csökken(het).
Ha emlőszövet tápfolyadékába radioaktív jelöléssel ellátott aminosavakat adunk, nyomon követhetjük sorsukat az alveoláris sejtekben:
- 3-15 percig a citoplazmában maradnak (ezalatt képzőnek az új fehérjék)
- 15-30 percen belül megjelennek a Golgiban (ekkor történik az új fehérjék csomagolása)
- 30-60 perccel később a lumenben vannak (a fehérjék szekrécióra kerültek)
Irodalomjegyzék
- Allen JC, Keller RP, Archer P, Neville MC.: Studies in human lactation: milk composition and daily secretion rates of macronutrients in the first year of lactation. Am J Clin Nutr. 1991 Jul;54(1):69-80. http://www.ajcn.org/content/54/1/69.full.pdf (2011.10.31.)
- Anderson SM, Rudolph MC, McManaman JL, Neville MC.: Key stages in mammary gland development. Secretory activation in the mammary gland: it's not just about milk protein synthesis! Breast Cancer Res. 2007;9(1):204. http://breast-cancer-research.com/content/9/1/204 (2011.10.31.)
- Cox DB, Owens RA, Hartmann PE.: Blood and milk prolactin and the rate of milk synthesis in women. Exp Physiol. 1996 Nov;81(6):1007-20. http://ep.physoc.org/content/81/6/1007.full.pdf (2011.10.31.)
- Cox, D.B., Owens, R.A., and Hartmann, P.E.: Studies on human lactation: the development of the computerized breast measurement system (1998). http://mammary.nih.gov/reviews/lactation/Hartmann001/index.html (2011.10.31.)
- Cregan MD, Mitoulas LR, Hartmann PE.: Milk prolactin, feed volume and duration between feeds in women breastfeeding their full-term infants over a 24 h period. Exp Physiol. 2002 Mar;87(2):207-14. http://ep.physoc.org/content/87/2/207.full.pdf (2011.10.31.)
- Daly SE, Kent JC, Huynh DQ, Owens RA, Alexander BF, Ng KC, Hartmann PE.: The determination of short-term breast volume changes and the rate of synthesis of human milk using computerized breast measurement. Exp Physiol. 1992 Jan;77(1):79-87. http://ep.physoc.org/content/77/1/79.long (2011.10.31.)
- Daly SE, Owens RA, Hartmann PE.: The short-term synthesis and infant-regulated removal of milk in lactating women. Exp Physiol. 1993 Mar;78(2):209-20. http://ep.physoc.org/content/78/2/209.long (2011.10.31.)
- Daly SE, Kent JC, Owens RA, Hartmann PE.: Frequency and degree of milk removal and the short-term control of human milk synthesis. Exp Physiol. 1996 Sep;81(5):861-75. http://ep.physoc.org/content/81/5/861.full.pdf (2011.10.31.)
- Hurst NM.: Recognizing and treating delayed or failed lactogenesis II. J Midwifery Womens Health. 2007 Nov-Dec;52(6):588-94.
- Kulski JK, Hartmann PE.: Changes in human milk composition during the initiation of lactation. Aust J Exp Biol Med Sci. 1981 Feb;59(1):101-14.
- Lawrence RA, Lawrence RM: Physiology of lactation. In: Breastfeeding – A Guide for the Medical Profession. 7th edition, Elsevier-Mosby (2011) pp 62-97.
- Neville MC, Allen JC, Archer PC, Casey CE, Seacat J, Keller RP, Lutes V, Rasbach J, Neifert M.: Studies in human lactation: milk volume and nutrient composition during weaning and lactogenesis. Am J Clin Nutr. 1991 Jul;54(1):81-92. http://www.ajcn.org/content/54/1/81.full.pdf (2011.10.31.)
- Neville MC: Milk secretion: an overview. 1998 http://mammary.nih.gov/reviews/lactation/Neville001/index.html (2011.10.31.)
- Nguyen DA, Parlow AF, Neville MC.: Hormonal regulation of tight junction closure in the mouse mammary epithelium during the transition from pregnancy to lactation. Journal of Endocrinology (2001) 170, 347–356 http://joe.endocrinology-journals.org/content/170/2/347.full.pdf (2011.10.31.)
- Pang WW, Hartmann PE.: Initiation of human lactation: secretory differentiation and secretory activation. J Mammary Gland Biol Neoplasia (2007) 12:211–221
- Roux ME, McWilliams M, Phillips-Quagliata JM, Weisz-Carrington P, Lamm ME.: Origin of IgA-secreting plasma cells in the mammary gland. J Exp Med. 1977 Nov 1;146(5):1311-22. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2180976/pdf/je14651311.pdf (2011.10.31.)
- Wilde CJ, Addey CV, Boddy LM, Peaker M.: Autocrine regulation of milk secretion by a protein in milk. Biochem J. 1995 Jan 1;305 ( Pt 1):51-8. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1136428/pdf/biochemj00072-0059.pdf (2011.10.31.)