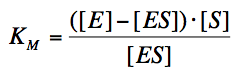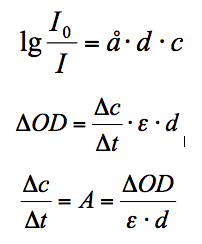Tartalomjegyzék
Malonát hatása a szukcinát-dehidrogenázra, az enzim aktivitásának mérése.
Enzimek kompetitív gátlása
- Kompetitív gátlás esetén a gátlószer olyan vegyület, ami szerkezetileg hasonlít a szubsztrátra.
- A szabad enzimhez kötődve megakadályozza a szubsztrát kapcsolódását, mintegy verseng a szubsztráttal az enzimhez való kötődésben.
- A szubsztrátkoncentráció emelésével a gátlás kivédhető. A kompetitív inhibitor hatására látszólag csökken az enzim affinitása a szubsztráthoz, tehát a KM érték nő.
- A vmax nem változik, mivel az ES-komplex kialakulása gátolt, de elbomlása nem!
- Ha a hányadosban az ES mennyisége csökken, mert az enzim egy része EI-komplexet képez, a tört értéke, azaz a KM nő.
- Látszólagos kompetitív gátlás esetén, az inhibitor nem az enzim aktív centrumához kapcsolódik, hanem valamely más csoportjához, és az enzimfehérje harmadlagos szerkezetének megváltoztatásával gátolja annak szubsztrátkötő képességét. Kinetikailag nem különböztethető meg a valódi kompetitív gátlástól. Az allosztérikus gátlások egy része is ilyen.
A szukcinát-dehidrogenáz
- A szukcinát-dehidrogenáz a citrát-ciklus egyik enzimje, ezért aktivitásának fokozása vagy gátlása közvetve befolyásolja a metabolitok többségének lebontását.
- Az enzim kofaktora a katalízis során a FAD, ami a reakció során FADH2-vé redukálódik:
szukcinát + E-FAD → fumarát + E-FADH2
- Az enzim a mitokondrium belső membránban lokalizálódik, amely mikroszóma-homogenizátumban szem veszíti el aktivitását.
Gyakorlat
- Az enzim a szukcinátról átvett hidrogént aktivitásának mértékében képes megfelelő redox festéknek átadni:
E-FADH2 + oxidált festék → E-FAD + redukált festék
- Az oxidált festék színtelen, míg a redukált festék piros színű. A festék nem autooxidábilis.
- Készítünk egy vak mintát, amiben mitokondriummembrán (E), puffer, szukcinát (S) és oxidált festék van, valamint a reakciót azonnal leállító FTF (formiát-triton-formalin).
- Készítünk egy hígítási sort, amelyben egyre nagyobb koncentrációban van jelen a szukcinát (S), és nincs a mintában malonsav (I), valamint FTF. A többi komponens megegyezik a vakkal.
- Készítünk egy hígítási sort, amelyben minden megegyezik az előző sorral, de ebben jelen van a malonsav (I) is.
- Az elegyeket 10 percen át 37 oC-on inkubáljuk, majd FTF-fel az összes mintában leállítjuk a reakciót.
- A mintákat 490 nm-en fotometráljuk, amikor is az extinció arányos lesz a redukálódott festékkel, tehát közvetve magával a produktummal, a fumaráttal.
- A Lambert-Beer törvény segítségével adott ε ismeretében produktum koncentrációt számolhatunk:
- Az aktivitást koordinátarendszerben ábrázolva, akár a MM-kinetika alapján, akár a reciprokábrázolással igazolhatjuk, hogy a malonsav gátolja a szukcinát-dehidrogenázt, ráadásul mivel a KM érték nő, a vmax nem változik (grafikus ábrázolásból leolvasható) a gátlás kompetitív volta is igazolt.