Tartalomjegyzék
LDH izoenzimek vizsgálata
A tejsav-dehidrogenáz enzimaktivitás szérumszintjének meghatározása más enzimaktivitások mérésével kombinálva (pl. glutaminsav-oxálecetsav-transzamináz, alanin-piruvát-transzamináz, kreatin-kináz stb) a klinikai orvosdiagnosztikában jól bevált, és széles körben használt módszer szövetszéteséssel vagy membrán permeabilitás változással együtt járó betegségek jellemzésére. Szívinfarktus esetén a LDH értéke kb. 12 óra elteltével emelkedni kezd, és 48-72 óra alatt éri el aktivitásának maximumát. Ezután visszatér a normál értékre kb. 7-12 napon belül. A LDH aktivitás emelkedés mértéke arányos a szívizom-károsodás mértékével, és akár az alapérték háromszorosát is elérheti. A szérum LDH szint növekedését ugyanakkor más esetekben (pl. anémiák, tumorok és a máj megbetegedései) is észlelni lehet, ezért fontos megállapítani, hogy az emelkedett szérum LDH szint mögött mely szövet károsodása áll. Ebben nyújt segítséget az LDH izoenzim profil vizsgálata. A tetramer LDH molekula kétfajta monomerből épülhet fel, mely fehérjéket külön gén kódol, így azoknak aminosav összetétele eltérő. A két alegységet H (heart = szív típusú) és M (muscle = izom típusú) betűvel jelöljük, és belőlük ötfajta LDH izoenzim épülhet fel.
- LDH-1 = LDH (H4)
- LDH-2 = LDH (H3M)
- LDH-3 = LDH (H2M2)
- LDH-4 = LDH (HM3)
- LDH-5 = LDH (M4)
Míg az LDH-1 és az LDH-2 izoenzimek főleg a szívizomban és az eritrocitákban fordulnak elő, a máj és a simaizmok LDH-5 izoenzimet tartalmaznak. Bár mindegyik izoenzim a tejsav + NAD+ piroszőlősav + NADH + H+ reakciót katalizálja, a különböző aminosav-összetétel miatt az izoenzimek mind enzimkinetikai módszerekkel, mind gélelektroforézissel és azt követő aktivitás-festéssel megkülönböztethetők.
I. ENZIMKINETIKAI MÓDSZEREK.
a.) hőstabilitás vizsgálata
A szérummintát NADH + H+ jelenlétében 30 percig inkubálják szobahőn, 57°C-on és 65°C-on. A tejsav dehidrogenáz enzimaktivitásának meghatározása lehűtőtt mintákból történik. A szobahőn tartott minta adja az össz enzimaktivitást. Az 57°C-on inkubált és a szobahőn tartott minta LDH aktivitásainak különbsége a hőlabilis LDH aktivitást (mely emelkedett májbetegségekben) adja. A 65°C-on inkubált enzimaktivitás a hőstabil LDH-t adja, melynek értéke emelkedett infarktusban.
b.) Szubsztrátkoncentráció függés vizsgálata
Azon fiziológiás jelentőségű különbséget használja ki, hogy míg az LDH-1 izoenzim maximálisan aktív 250 mM tejsavkoncentrációnál, addig az LDH1 enzim tejsav koncentráció optimuma 10 mM, és 250 mM tejsav az LDH1 izoenzim aktivitását kb. 50 %-ban gátolja. Így ha a enzim aktivitást megmérik 10 mM és 250 mM tejsav koncentrációnál, a mért aktivitások arányából eldönthető, hogy a minta zömmel LDH-1 vagy LDH-5 izoenzimet tartalmaz-e.
c.) Szubsztrát specificitás vizsgálata
A meghatározás azon alapszik, hogy a különböző izoenzimek más affinitást mutatnak 0,33 mM piruvát, ill. 3,3 mM 2-oxobutirát (HB) szubsztrátokat használva. Az LDH-1 izoenzim aktívabb oxobutiráttal, míg az LDH-5 izoenzim sokkal nagyobb enzimaktivitást mutat piruvát használata esetén. A HBDH/LDH arány normál szérumban 0,63 - 0,81 közötti érték. Ha a szérumból mért enzimaktivitás arány nagyobb, mint 0,81, az infarktusra enged következtetni, míg a 0,63-nél kisebb értékek májmegbetegedésre utalnak. Jelen gyakorlaton a klinikumban általában használt c.) módszert fogjuk alkalmazni. A spektrofotometriás mérés alapja, hogy a NADH molekula abszorpciós spektrumában 340 nm-en található abszorpciós csúcs a NAD+ molekula spektrumában hiányzik. Így, ha az 1. egyenlet értelmében oxo-szubsztrátból és NADH-ból indulunk ki, 340 nm-en abszorbciócsökkenést mérünk az inkubációs idő függvényében, mely az enzimaktivitással arányos. e 340nm = 6,22 * 103 cm2 /mmol
Oldatok:
- 1.) 0,05 M foszfát puffer, pH 7,5
- 2.) 8×10-3M NADH oldat foszfát pufferben oldva
- 3.) 10-2M piroszőlősav foszfát pufferben oldva
- 4.) 10-1M a-ketobutirát foszfát pufferben oldva
- 5.) LDH-1 enzim
- 6.) LDH-5 enzim
A kísérlet kivitelezése:
Mérjük a fotométer küvettáiba az alábbi komponenseket (ml):
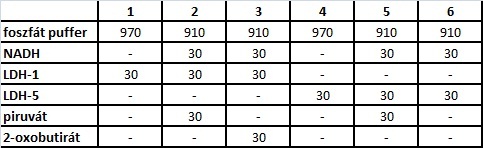
Az 1. mintát vakként használva mérjük az LDH1 kiindulási aktivitását a 2. és 3. küvettában, majd a piruvát, ill. 15 másodperccel később a 2-oxobutirát hozzáadásával indítjuk a reakciót a 2. és 3. küvettában. Az extinkciót fél percenként 340 nm-en mérjük. A 4. küvettát vakként használva az 5. és 6. minta fotometrálását hasonlóan végezzük. Az extinkció - reakcióidő görbe lineáris szakaszából számoljunk enzimaktivitást. enzimaktivitás (U/l)=(E*V*1000)/(min*6,22*v) ahol:
- V a reakcióelegy össztérfogata [ml]
- e NADH 340 nm: 6,22 [cm2 × mol-1]
- d küvetta rétegvastagsága [cm]
- v vizsgált szérum térfogata [ml]
Számoljuk ki a HBDH/LDH hányadosokat.
II. ELEKTROFORETIKUS MÓDSZER
Az LDH izoenzimek elektroforézissel egymástól jól elválaszthatók. Az LDH-1 enzim vándorol a leggyorsabban az anód felé, az LDH-5 alig mozdul el a felvitel helyéről. A többi izoenzim a H típusú alegység mólaránya függvényében vándorol egyre növekvő sebességgel az anód felé. Az elektroforézis kivitelezhető mind agaróz, mind cellulóz-acetát, mind poliakrilamid hordozókon. Az izoenzimek láthatóvá tehetők az ún. aktivitásfestés technikával, mivel az enzimreakció működése során oldhatatlan színes termék keletkezik a gélben, ott ahol a kérdéses fehérje található.
Anyagok
- 1.) előre öntött 6,5%-os poliakrilamid gél
- 2.) futtató-puffer
- 3.) LDH minták, minta-pufferben
- 4.) 1 M TRIS, pH 7,4
- 5.) 0,01 M NAD+
- 6.) 1 mg/ml tetrazólium-kék
- 7.) 1,6 mg/ml fenazin-metaszulfát,
- 8.) 1 M Na-laktát
A kísérlet kivitelezése: Az előkészített gél mintafelvivő zsebét mossuk ki a futtató-pufferrel, majd erősítsük a kádhoz az üveglapok között levő poliakrilamid gélt. Pipettázzunk 20-40 ml mintát a különböző LDH preparátumokból a zsebekbe, majd óvatosan rétegezzünk futtatópuffert a minták fölé. Töltsük fel a futtatókádakat, csatlakoztassuk a vezetékeket (pozitív pólus van alul) és adjunk feszültséget (maximum 200 V , ill. 50 mA) a készülékre. A gyakorlatvezető utasítása szerint másfél óra elteltével szedjük szét a készüléket, feszítsük szét az üveglapokat, majd a gélt rakjuk az előhívó oldatba (14,8 ml víz, 4 ml 1 M-os TRIS puffer, 12 ml tetrazólium-kék, 4 ml fenazin-metaszulfát, 4 ml 1 M-os Na-laktát) és inkubáljuk 45°C-on 10 percig sötétben. Mossuk a gélt vízzel, majd szárítsuk meg szűrőpapír között. Az izoenzimek helyét a lerakódott formazán mutatja. A színreakcióban a NAD+ a koenzim, a laktát a szubsztrát, a fenazin-metaszulfát az elektronkarrier, míg a tetrazólium kék a végső elektronakceptor.
Az elektroforézis eredménye
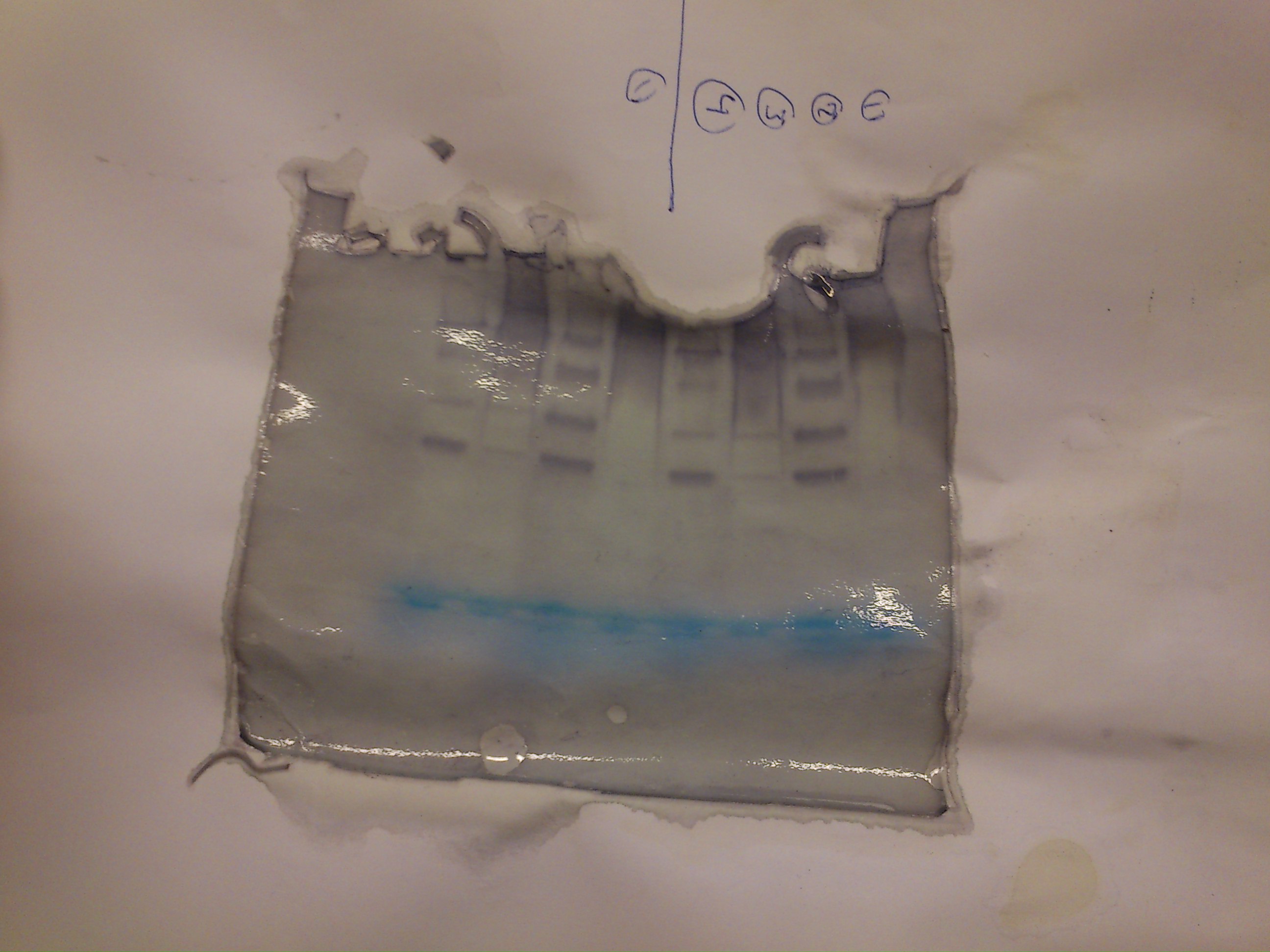
Válaszoljon az alábbi kérdésekre:
- 1.) Hány csíkot lát a különböző mintákban?
- 2.) Van-e különbség a különböző csíkok színerőssége között?
- 3.) Mivel magyarázhatja a csíkok periodikus elhelyezkedését?
- 4.) Mi a különböző izoenzimek eltérő vándorlási tulajdonságának magyarázata?
- 5.) Mi az aktivitás-festés alapja?
- 6.) Mi a spektrofotometriás differenciál-diagnosztika alapja?