Tartalomjegyzék
Fizikai kémia
Általános leírás a tárgyról
- alapvető fizikai kémiai ismeretek megszerzése
- 3. szemeszterben csak előadás, 4. szemeszterben csak gyakorlat, gyakorlati előkészítővel
- 4. szemeszter gyakorlataira az adott gyakorlati anyaga kell, mert beugró van
- Első félév első felében Turányi tanár úr tart előadásokat a termodinamika tárgyköréből elsősorban. Az előadásdiák elérhetőek a honlapján, az előadás látogatása nem kötelező. Nem kötelező jegymegajánló ZH írható, amelyre általában a 8-9. hét környékén kerül sor. Itt 20 pont szerezhető definíciókból (minimumkövetelmény a 10 pont megszerzése ennél a résznél), amelyeket a honlapon megtalálható kislexikonból kell/érdemes megtanulni. 30 pont kapható a feladatokra, amelyek nagyon hasonlítanak a honlapon található feladatokhoz, gyakran csak a számokat cseréli ki a tanár úr. 50 pont jár 2 tétel részletes kifejtéséért, amelyeknek egyébként kb. fele definíció. Csak azt kell megtanulni, ami szerepel a tanár úr diáin, semmi mást. Összességében nagyon konkrétan megfogalmazott követelményrendszerről beszélhetünk, ha valaki becsülettel tanul rá, garantált a siker.
- Az első szemeszter második felében Láng Győző tanár úr okít az elektrokémia és méréstechnika tárgyköréből. Az előadásokon legalább 66%-os részvétel szükséges, van katalógus. Itt is van fakultatív jegymegajánló ZH, amely a 14. héten szokott lenni. Aki az előadások kevesebb, mint 2/3-án volt, az nem írhat jegymegajánló ZH-t elektrokémiából, vizsgáznia kell. A ZH-n a kérdezett definíciók felét tudni kell, ellenkező esetben elégtelen. Vannak hosszabb kifejtős feladatok még az elméleti részben. A számolásokhoz használható az Elektrokémia című jegyzet (nem sokat segít, de a standard elektródpotenciálok innen nézhetők ki), valamint 1-2 segédanyag, amit a tanár úr elmond. Lehet pluszpontot szerezni, amely a beugró (definíció) pontokhoz adódik hozzá házi feladatok elkészítéséből. A tanár úr minden előadáson ad házi feladatot, amelyet (mindegyik feladatot kézzel írva, külön lapon!) egy héten belül be lehet adni, és mindegyik jó megoldásért kapható pluszpont. Akár 20 pont is szerezhető házi faladatokkal (a kb. 80 pontos ZH-nál), érdemes őket megcsinálni. Általában valamilyen jelenségnek, kifejezésnek kell utánaolvasni.
- A vizsga úgy történik, hogy akinek nincs megajánlott jegye, vagy javítani szeretne, az ír beugrót, tételt húz, lefelel (mind elektrokémiából, mint pedig termodinamikából külön-külön). A termodinamika és az elektrokémia átlagának egészrésze a vizsgajegy.
- Második félévben tömbösítve van laborelőkészítő előadás, amelyen elég szigorúan ellenőrzik a részvételt. Minden héten van labor (1 vagy 2. emelet), amelyek beugróval indulnak az aktuális mérésből. Itt ha valaki nem ér el egy bizonyos szintet, hazaküldik. Minden laborra vinni kell az előző hét méréséről a jegyzőkönyvet, amelynek kismillió formai követelménynek meg kell felelnie (így egy jó jegyzőkönyv megírása órákig tart). Ha valami nem jó, pl. nem szedi valaki dőlt betűvel a fizikai mennyiséget, visszaadják a jegyzőkönyvet javításra. A mérési adatok kiértékeléséhez OriginLab programra van szükség, az Excel nem jó a gyakorlatvezetők szerint.
- Van 2 ZH második félévben, amelyekben a mérések elméleti hátterét kérik számon. Ezeknek és a jegyzőkönyvekre kapott érdemjegyek átlagát felfelé vagy lefelé kerekítik tetszés szerint (vicc nélkül, ezt nevezik „pofafaktornak”), így jön ki a gyakorlati jegy.
- Az intézet oktatóinak honlapjain rengeteg hasznos segédanyag van fent, érdemes nézegetni és tanulgatni őket. Az intézet precízen megadja, mit kér számon és mit nem, jól fel lehet készülni a ZH-kra.
| A tárgy adatlapja | |
|---|---|
| kódja a Neptunon | 3. szemeszter: GYFKTFIKE1M (4 kredit) / 4. szemeszter: GYFKTFIKG2M (5 kredit) |
| előfeltétele | 3. szemeszter: Általános és szervetlen kémia II., Matematika II., Biofizika II. / 4. szemeszter: Fizikai kémia I. |
| típus | 3. szemeszter: előadás / 4. szemeszter: gyakorlat |
| intézet | ELTE TTK Kémiai Intézet Fizikai-Kémiai Tanszék |
| intézet honlapja | http://garfield.chem.elte.hu/Turanyi/oktatas/fizkem_gyogyszeresz.html; http://garfield.chem.elte.hu/Turanyi/oktatas/fizkemlabor_gyogyszeresz.html |
| oktatási felelős | Dr. Turányi Tamás |
| elérhetősége | [email protected] |
| számonkérés típusa év közben | 3. szemeszter: nincs kötelező jeleggel / 4. szemeszter: 2 ZH és gyakorlatokon szóban és írásban felelés |
| jegymegajánlás/tanulmányi verseny | 3. szemeszter: két nagyobb részből áll (termodinamika, elektrokémia), mindkettőből 1 db jegymegajánló ZH van, a kettő átlaga lefelé kerekítve a megajánlott jegy |
| félévek száma | 2 |
| vizsga típusa | 3. szemeszter: ha az adott részből nem fogadod el a megajánlott jegyet, akkor abból a témakörből szóbeli kollokviumot kell tenni; 4. szemeszter: gyakorlati jegy |
| nehézség | átlagos nehézségű tárgy |
| ráépül | 4. szemeszter: Fizikai kémia II., Kolloidika I. / 5. szemeszter: Gyógyszerészi kémia I., Gyógyszertechnológia I., Kolloidika II. |
Tankönyvek, jegyzetek
Biztosan kelleni fog
- Takács M (szerk.): Fizikai kémia gykorlatok (jegyzet, Semmelweis Kiadó, 2006)
- Kiss L, Láng Gy: Elektrokémia
- Szalma J, Láng Gy, Péter L: alapvető fizikai kémiai mérések és a kísérleti adatok feldolgozása (ELTE, Eötvös Kiadó, 2006)
Hasznos lehet
- Póta Gy: Fizikai kémia gyógyszerészhallgatók számára (3. átdolgozott kiadás, Kossuth Egyetemi Kiadó, Debrecen, 2003)
- Kiss László: Bevezetés az elektrokémiába (Nemzeti Tankönyvkiadó, Budapest, 1997)
Mérések
1
híg karbamidoldat fagyáspontcsökkenésének meghatározása
a mérés célja
- híg vizes karbamidoldat fagyáspontcsökkenésének mérésével meghatározzuk a karbamidoldat koncentrációját tömegszázalékban
a mérendő adatok
- a tiszta víz fagyáspontja
- a karbamidoldat fagyáspontja
- az oldat túlhűlési foka
a mérés leírása
- konyhasó, jég és csapvíz fölhasználásával hűtőkeveréket készítettünk, hőmérsékletét -4 és -6°C közé állítottuk
- fagyasztó kémcsőbe desztillált vizet töltöttünk
- közvetlenül a só-jég keverékbe helyeztük a fagyasztó kémcsövet állandó keverés mellett addig, amíg a termisztoron kijelzett érték elért egy minimumot (túlhűlés)
- a fagyasztó kémcső falát szárazra törölve a hőszigetelő légköpenybe helyeztük és állandó keverés mellett 10 másodpercenként följegyeztük a feszültségértékeket 3 percen keresztül
- a mérési eredményeket mérési adatlapon rögzítettük
- a kémcsövet kezünkkel fölmelegítve fölolvasztottuk a jeget és megismételtük a mérést még kétszer
- a tiszta és száraz kifagyasztó kémcsőbe beletöltöttük az ismeretlen koncentrációjú karbamidoldatot és háromszor megismételtük a mérést
számolás
- a mért feszültségértékeket (mV) a mérőhelynek megfelelő lineáris kalibrációs egyenlettel átszámoltuk °C-okra
- a 4-es mérőhelynek megfelelő kalibráció:
- U = -152,88844 + 12,43003 * T
- ahol U a mért feszültségérték (mV)
- T a kiszámolandó hőmérséklet (°C)
- a függvény korrelációs együtthatója 0,99999
- az eredményeket kinyomtatva a jegyzőkönyvhöz csatoltam
- a három desztillált vizes mérés 30 eredményének átlaga:
- T0 átlag: 0,71752 °C
- a karbamidoldatok mérések 10 fagyáspontjának átlaga, a túlhűlés hőmérséklete és a túlhűlés mértéke:
- 1. mérés
- TS1 átlag: -0,24952 °C
- Ttúlhűlés1: -0,57213 °C
- ΔTt = TS1 - Tt1 = 0,32261 °C
- 2. mérés
- TS2 átlag: -0,28331 °C
- Ttúlhűlés2: -0,58017 °C
- ΔTt = TS2 - Tt2 = 0,29686 °C
- 3. mérés
- TS3 átlag: -0,25757 °C
- Ttúlhűlés3: -1,58580 °C
- ΔTt = TS3 - Tt3 = 1,32823 °C
- a kifagyott jég mennyiségének számolása:
- Hf * mj = cv * ms * ΔTt
- ahol
- Hf = 333,62 kJ / kg a víz fagyási entalpiája
- cv = 4,156 kJ / (K * kg) a víz fajlagos hőkapacitása
- ms = 0,02 kg a karbamidoldat tömege
- behelyettesítve:
- mj = (2,509 * 10-4 kg / K) * ΔTt
- 1. mérés
- mj = 8,0942849 * 10-5 kg
- 2. mérés
- mj = 7,4482174 * 10-5 kg
- 3. mérés
- mj = 3,33252907 * 10-4 kg
- a krioszkópos állandó: Km = 1,86 kg * K / mol
- kiszámoljuk a cm értékét: (egyelőre rossz behelyettesített értékekkel !!fix me!! )
- Ta = 0,00 °C
- cm = (Ta - Ts) / Km
- 1. mérés
- cm = 0,57213 / 1,86 = 0,30760 mol / kg
- 2. mérés
- cm = 0,58017 / 1,86 = 0,31192 mol / kg
- 3. mérés
- cm = 1,58580 / 1,86 = 0,85258 mol / kg
- a karbamid moláris tömege: 0,06 kg / mol
- az eredeti oldat koncentrációja tömegszázalékban:
- m % = (100 / ms) * [(ms - mj) / [(Km) / (ΔT * MB)] + 1]
- 1. mérés
- 5000 * ( 0,019919 / [(1,86 / (0,57213 * 0,06 )) + 1)] = 5000 * 3,609 * 10-4 = 1,8048 m/m%
- 2. mérés
- 5000 * ( 0,019926 / [(1,86 / (0,58017 * 0,06 )) + 1)] = 5000 * 3,661 * 10-4 = 1,8303 m/m%
- 3. mérés
- 5000 * ( 0,019667 / [(1,86 / (1,58580 * 0,06 )) + 1)] = 5000 * 9,5709 * 10-4 = 4,7855 m/m%
- a három mérés átlaga:
- 2,8069 m/m%
az eredmények megadása táblázatos formában
| kísérlet száma | fagyáspontcsökkenés | a kifagyott jég tömege | az oldat molalitása | koncentráció |
|---|---|---|---|---|
| ΔT / °C | mj / kg | cm / mol/kg | m / m % | |
| 1. | 0,32261 | 8,0942849 * 10-5 | 0,30760 | 1,8048 |
| 2. | 0,29686 | 7,4482174 * 10-5 | 0,31192 | 1,8303 |
| 3. | 1,32823 | 3,33252907 * 10-4 | 0,85258 | 4,7855 |
2
higanyos hőmérő kalibrálása
a mérés célja
- a 0 és 100°C hőmérséklettartományban működő higanyos hőmérőt három pontosan ismert egyensúlyi hőmérséklettel való összehasonlítás alapján kalibráljuk
- a hőmérsékletek különbsége segítségével kalibrációs függvényt szerkesztünk
- a °C-okban megadott pontos hőmérsékletekből 273,15K hozzáadásával a rendszer termodinamikai hőmérsékletét kapjuk meg
a mérendő adatok
- a víz fagyáspontja
- a Na2SO4 10 H2O olvadék/szilárd egyensúlyi rendszer hőmérséklete
- a forrásban lévő víz/gőz egyensúlyi rendszer hőmérséklete
- adatok a fonálhossz-korrekció számolásához
- adatok a nullapont-depresszió számolásához
a mérés leírása
- a víz fagyáspontjának észlelése (Tm,1)
- olvadó jég/víz keveréket készítünk, a hőmérőt 0°C-ig belemerítve, kevergetve leolvassuk a hőmérsékleteket
- a Na2SO4 10 H2O olvadék/szilárd egyensúlyi rendszer hőmérsékletének (Tm,2) észlelése
- Bunsen-láng fölött megömlesztjük a kémcsőbe töltött glaubersó felét és a hőmérsékletét állandó keverés mellett leolvassuk
- a forrásban lévő víz/gőz egyensúlyi rendszer hőmérsékletének észlelése (Tm,3)
- a hőmérőt 100°C-os beosztásig a gőztérbe helyezzük
- az egyensúly a forrásban lévő víz gőze és a hőmérőn kondenzálódott folyadék között valósul meg
- adatok gyűjtése a fonálhossz-korrekció számolásához
- a hőmérőt a dugó fölé húzzuk
- a dugó fölső szintjénél lévő hőmérsékletet lejegyezzük
- a kiálló fonál feléhez illesztjük a külső hőmérőt
- megfigyeljük a hőmérő legkisebb és a külső hőmérő legnagyobb mutatott értékét
- adatok gyűjtése a nullapont-depresszió számolásához
- a forró hőmérőt olvadó jégbe merítjük
- megfigyeljük a minimumhőmérsékletet(Tmin)
- hőmérsékletmérés két eltérő hőmérsékletű (27°C és 37°C) termosztátban
Kiértékelés
- a víz fagyáspontja és az ebből kiszámolt korrekciós érték:
- a víz mért fagyáspontja: Tm,1= 0,113°C
- ebből a korrekciós érték: ΔT1=0°C-Tm,1= -0,113°C
- a Na2SO4*10H2O olvadék/szilárd egyensúlyi rendszer hőmérséklete és az abből kiszámolt korrekciós érték:
- a mért hőmérséklet: Tm,2= 32,396°C
- ebből a korrekciós érték: ΔT2=32,38°C-Tm,2= -0,016°C
- a víz forráspontja és az ebből kiszámolt korrekciós érték
- a víz mért forráspontja: Tm,3= 99,726°C
- a víz aktuális (pontos) forráspontja:
- a skála korrekció nélküli légkör nyomás (barométerről leolvasott értékek alapján): pr=pf-pa= 821Hgmm-70Hgmm= 751Hgmm
- légköri nyomás skálakorrekcióval: p(T=0)=pT-T/8=751Hgmm-22,75°C/8= 748,156Hgmm
- a légköri nyomás Pascalban: pkülső=p(T=0)*133,32=748,156*133,32=99744,158Pa
- a pontos forráspont: Tf= 100,00°C+(pkülső-101325Pa)*2,75*10-4°C/Pa=99,565°C
- ebből a korrekciós érték: ΔT3=Tf,aktuális-Tm,3=99,565°C-99,726°C= -0,161°C
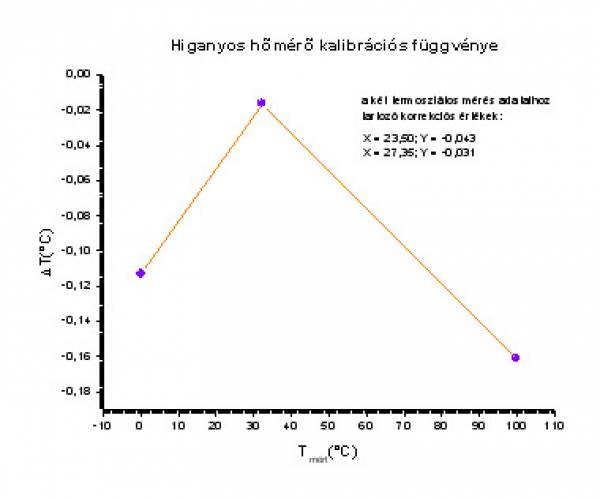
- a termosztátos hőmérsékletmérés adatainak korrekcióját a korrekciós grafikonról leolvassuk/ld grafikon/:
- így a tényleges hőmérsékletek:
- T4,tényleges=T4,mért+ΔT4=23,50+(-0,043)=23,457°C
- T5,tényleges=T5,mért+ΔT5=27,35+(-0,031)=27,319°C
- a számolt fonálhossz-korrekció és a mért fonálhossz-korrekció:
- Tkülső=34,371°C Tbelső=99,100°C n=99,10-30,00=69,10°C (30°C-ig volt kihúzva a hőmérő) β=1,6*10-4
- ΔTfonál=β*n*(T-Tk)= 0,716°C
- ΔTfonál, mért=99,726-99,100= 0,626°C
- a nullapont-depresszió értéke:
- Tmin= 0,090°C
- Td=Tm,1-Tmin= 0,113°C-0,090°C= 0,023°C
Grafikon
3
Sn/Pb ötvözetek termikus analízise, fázisdiagram szerkesztése
a mérés célja
Sn-Pb rendszer fázisdiagramjának megszerkesztése különböző ötvözetek lehülési görbéi alapján. Termoelemmel történő hőmérsékletmérés elvi alapjainek megismerése.
a mérés leírása
- a lehülési adatok felvételét számítógép vezérelt mérésadatgyűjtő rendszerrel végezzük. Az ötvözetek megolvasztása elektromos fűtésű kemencében történik. a hőmérsékletet vaskonstantán termoelemekkel mérjük. A fémeket a levegő oxigénjének oxidáló hatásától szénporral védjük (egyik fém sem karbidképző) A tartóedény anyagával való reakció elkerülése érdekében kvarcból készült csöveket alkalmazunk.
- Fázisátmeneti helyek megkeresése a lehülési görbéken.
- termofeszültség-skála kalibrálása. A hőm. és a termofesz. kapcsolatát lineáris fv-nyel írjuk le. Az Sn és Pb mellé a Zn olvasádpontját is felhasználjuk, mint referencia hőmérséklet. Kalibrációs egyenlet: T=a+b*Uterm
- az olvadás- és eutektikus pontok termofeszültség adatait a kalibrációs fv segítségével átszámítjuk oC-ra
- fázisdiagram megszerkesztése grafikus értékelő programmal
- az eutektikus összetétel megállaításához a fázisdiagrammoknak azt a részét, ahol a két likvidusz görbe találkozik, kinagyítjuk, majd leolvassuk az eutektikus összetételt.
számolás
- 32. oldal alpján
mérési eredmények megadása
- eutektikus összetétel megadása tömegszázalékban (3 értékes jegyre)
- eutektikus hőmérséklet megadása 95%os statisztikus biztonsághoz tartozó hibahatárokkal
mellékelve a jegyzőkönyvhöz
- értékelő adatlap
- termoelem kalibrációs fv grafikonja és egyenlete
- fázisdiagram
- adattáblázat
6
Oldatok felületi feszültségének meghatározása
a mérés célja
Különböző koncentrációjú vizes i-butil-alkoholok és egy ismeretlen oldat felületi feszültségének meghatározása buboréknyomás mérésének módszerével és az ismeretlen oldat sűrűségének mérése Mohr-Westphal mérleggel
mérés menete
- megmérjük a víz, a megadott oldatsorozat és az ismeretlen oldat buboréknyomását
- feljegyezzük a mérés hőmérsékletét!
- ismeretlen oldat sűrűségének megmérése
kiértékelés
- a kapilláris sugarának kiszámítása
- r = 2γ / ρ*g*(Δh-h1)
- ahol h1 = 0,005 m, γ = 0,07253 N/m, g = 9,81 m/s2 és ρ a mérés hőmérsékletén a víz sűrűsége.
- i-butanol tartalmú oldatok felületi feszültségének kiszámítása
- γold = ρold * r * g * (Δh-h1) / 2
- feltesszük, hogy az oldat sűrűsége (ρold) egyenlő az adott hőmérsékletre vonatkozó víz sűrűségével
- ismeretlen oldat felületi feszültségének kiszmítása
- az alkoholhoz hasonlóan, DE a sűrűség a mérleggel mért adat!
megadandó mérési eredmények
- desztvízre a h(átl) (m)
- kapilláris sugara (m)
- vizes i-butanol oldatsorozatra táblázatosan
| V(i-but) / cm3 | c mol/dm3 | Δh(átl) / m | γib / N/m |
|---|
- a felületi többlet mennyisége (mértékegysége mol/m2)
- ismeretlen oldat
- sűrűsége
- h(átl) (m)
- mérés hőmérséklete
- felületi feszültsége (N/m)
jegyzőkönyvhöz csatolva
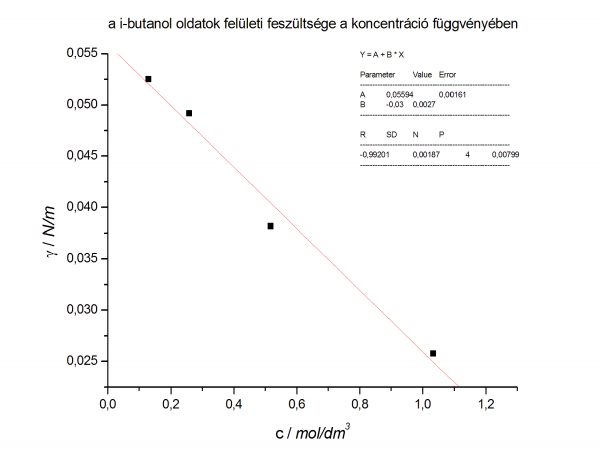
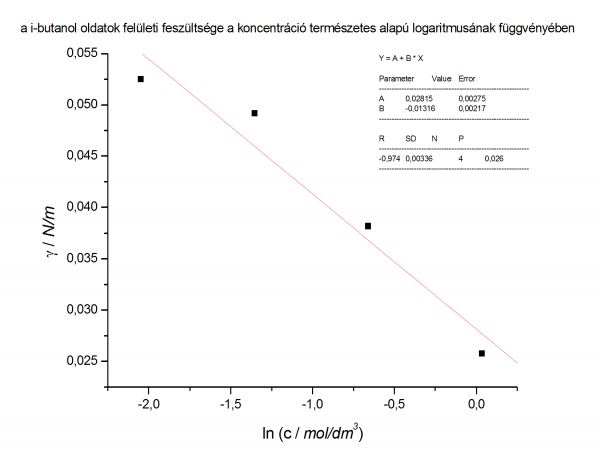
- 2 grafikon
- felületi fesz vs koncentráció
- felületi fesz vs ln c
- ennek meredekségéből meghatározzuk a felületi többlet mennyiséget
példa eredmények
- 23,5 °C-on (997,421 kg/m3 a víz sűrűsége)
- a mért Δh értékek:
- víz: 0,0446 m
- harmadik i-butanol oszlop sorrendben:
- 0,01908 m
- 0,02586 m
- 0,03187 m
- 0,03370 m
- az ismeretlen: 0,04169 m
- az ismeretlen sűrűsége: 1,035 g/cm3
- a kapilláris sugara: 0,374 mm
- az i-butanol oldatok felületi feszültsége:
- 2,4 cm3 γ = 0,02576 N/m
- 1,2 cm3 γ = 0,03817 N/m
- 0,6 cm3 γ = 0,04917 N/m
- 0,3 cm3 γ = 0,05251 N/m
- az ismeretlen felületi feszültsége: 0,06966 N/m
- az oldatsorozat felületi többlet mennyiségének meghatározása, ábrázolandó adatok
| γ / N/m | c / mol/dm3 | ln c |
|---|---|---|
| 0,02576 | 1,0336 | 0,0331 |
| 0,03817 | 0,5168 | -0,6601 |
| 0,04917 | 0,2584 | -1,3532 |
| 0,05251 | 0,1292 | -2,0464 |
- a két csatolt függvény:
- az egyenes egyenlete: y = 0,02815 + (-0,01316) * x
- γ = - Γ * R * T * ln c + konst.
- - Γ * R * T = -0,01316 ahol R * T = 8,314 * 296,5
- Γ = 5,34 * 10-6mol/m2
7
Festékelegy elválasztása oszlopkromatográfiás módszerrel
a mérés célja
Két festék - szudán III és az erioglaucin - keverékének elválasztása oszlopkromatográfiás módszerrel. Az eljárás végén fotometriás módszerrel meghatározzuk a festékoldatok koncentrációját. (kulcsszavak: oszlopkromatográfia, fotometria)
a mérés leírása
- a festékeket adszorpciós kromatográfiával választjuk szét. mozgó fázisként etanol-víz elegyet használunk. A négykomponensű rendszer szorpciós sorrendje alumíniumoxidon: H2O > erioglaucin > CH3CH2OH > szudán III
- 96%os etanolban feloldva a két festéket és az oszlopra töltve a szorpciós sorrendnek megfelelően a szudán III végighalad az oszlopon, az erioglaucin adszorbeálva az oszlop tetején marad.
- a mozgó fázist kicserélve a 30%os etanolra a víz eluálja az erioglaucint
- Fotometriánál híg oldatokkal dolgozunk, ezért az abszorbanciájuk egyenesen arányos a koncentrációjukkal (Lambert-Beer-törvény)
- mindkét festékből higítási sort készítünk és megmérjük a fényelnyelését a maximális elnyelés hullámhosszánál.(szudán III-nál 530 nm, erioglaucinnál 655 nm)
- az abszorbancia vs. koncentráció függvényből meghatározzuk az elválasztott festékek koncentrációját.
Kromatográfiás oszlop készítése
- 10-15 ml alumíniumoxid szuszpenziót készítünk 96%os etanolból 25 ml-es főzőpohárban
- összeállítjuk/ellenőrizzük a készüléket (tk-i ábra alapján)
- az üvegcső aljára Witt-lemezt illesztünk, fölé kb. 1 cm vastagságban 96%os etanollal megnedvesített vattát teszünk, majd rárétegezzük az alumínium szuszpenziót. (rétegvastagság: a cső hosszának a fele, 2/3a)
- 96%os etalolt töltünk az oszlop tetejére majd abba belefecskendezzük a 2.0 cm3 ismeretlen estékelegyet
- fontos: a szivatás kezdetétől a végéig mindig legyen 1-2 cm3 folyadékréteg az oszlop felett, mert az oszlop megrepedezik és újra kell kezdeni
- szivatás szívópalack segítségével
- várunk, amíg az utolsó részlet piros komponens a mintagyűjtő szívópalackba kerül
- megszüntetjük a szívást
- a palack tartalmát átmossuk kvantitatíve 96%os etanollal egy 50 ml-es mérőpohárba
- tiszta, száraz gyűjtőedénnyel és 30%os etanollal megismételjük ugyanezeket a lépéseket.
Fotometria
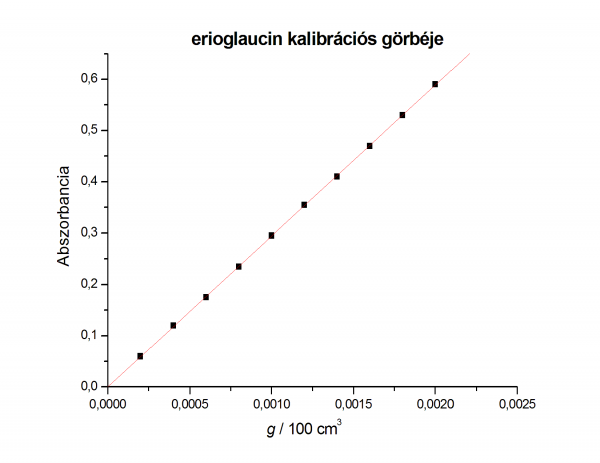
| összetétel | abszorbancia | koncentráció | |
|---|---|---|---|
| szudán III | erioglaucin | g/100 cm3 | |
| 0,2/1,8 | 0,085 | 0,060 | 0,0002 |
| 0,4/1,6 | 0,170 | 0,120 | 0,0004 |
| 0,6/1,4 | 0,245 | 0,175 | 0,0006 |
| 0,8/1,2 | 0,330 | 0,235 | 0,0008 |
| 1/1 | 0,415 | 0,295 | 0,001 |
| 1,2/0,8 | 0,505 | 0,355 | 0,0012 |
| 1,4/0,6 | 0,590 | 0,410 | 0,0014 |
| 1,6/0,4 | 0,675 | 0,470 | 0,0016 |
| 1,8/0,2 | 0,760 | 0,530 | 0,0018 |
| 2/0 | 0,830 | 0,590 | 0,002 |
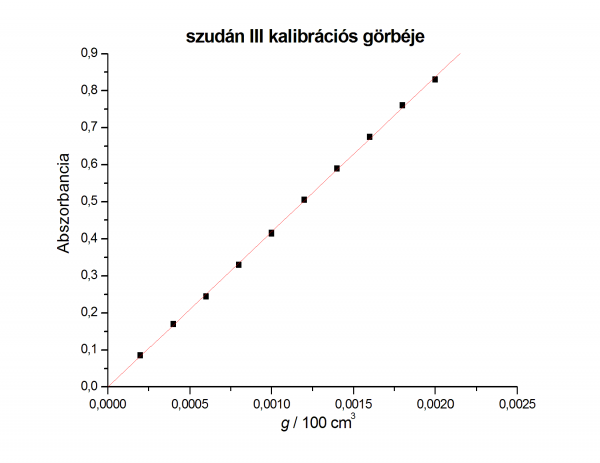
- szudán III oldat elnyelését megmérjük
- 530 nm-en (100% transzmisszió érték a referencia 96%os etanolos oldatra)
és 6 minta abszorbanciáját megmérjük (4 kalibráló oldat, törzsoldat és az elválasztot festék minta)
- erioglaucin oldat elnyelését megmérjük
- 655 nm-en (100% transzmisszió érték a referencia 30%os etanolos oldatra)
és 6 minta abszorbanciáját megmérjük (4 kalibráló oldat, törzsoldat és az elválasztot festék minta)
kiértékelés, számolás
- abszorbancia-koncentráció fv 5 pontjára egyenest illesztünk
- fontos, hogy az egyenest illesszük és átmenjen a (0;0) ponton
- a kalibrációs egyenesek originben ábrázolva: kalibrációs grafikonok
- leolvassuk az ismeretlen oldat abszorbanciája alapján a higított oldat koncentrációját
- egyenes egyenletéből is ki lehet számolni a koncentrációt
- elválasztáskor a kezdeti térfogatot az eluálószer megnöveli (V0= 1 cm3)így anyagmegmaradás törvénye lapján: V0*c0 = V1*c1, ahol c0 az ismeretlen koncentráció, V1 = 25 cm3, a higított oldat térfogata a c1 kalibrációs görbéről leolvasott koncentráció
mellékelve a jegyzőkönyvhöz
- ábrázoljuk a két kalibrációs sorozat A vs ccfesték fv-t. az illesztett egyenesek alapján vagy grafikus leolvasás segjtségével meghatározzuk az ismeretlen koncentrációkat a higított oldatban
- a higítás figyelembe vételével kiszámoljuk a kapott ismeretlen oldatban a két festék koncentrációját g/cm3 egységben.
körülbelüli értékek
- a kalibrációs egyenesről leolvasott koncentrációk:
- szudánIII » 7,15*10-4 g/100 cm3
- erioglaucin » 7,28*10-4 g/100 cm3
- a hígítást is figyelembe véve a koncentrációk:
- szudánIII » 0,0179 g/100 cm3
- erioglaucin » 0,0182 g/100 cm3
8
Gőz - folyadék egyensúly tanulmányozása kétkomponensű elegyekben
Mérés célja
Különböző összetételű aceton/CHCl3 elegyek forráspontjának és törésmmutatójának meghatározása. A forratlan elegyek törésmutató-össetétel függvénye alapján a minták összetételéne meghatározása. Forráspont diagram szerkesztése.
Mérés
Táblázatos elrendezés a legegyszerűbben(oszlopok nevei)
V% aceton; n(elegy)-forr.előtt; T/°C-forr.pont;n(gőz)-forr.ponton; n(folyadék)-forr.ponton
mérés menete
- a mérőpár egyik tagja elkezdi elkészíteni a kiegészítésben megadott összetételű elegyeket
- közben a másik elkezdheti mérni a tiszta anyagok forráspontját, illetve törésmutatóit
- célszerű rögtön felrakni forrni a tiszta acetont és kloroformot (25 cm3) és közben megmérni a refraktométerrel a forratlan elegyek törésmutatóit
- forralásnál: bekapcsoljuk a készüléket, hűtővizet megindítjuk,és fontos, hogy elegendő minta legyen, hogy a belső háromszárú üvegben fecskendezni tudjon a folyadék, így a forratlan törémutató mehatározásnál csak kevés mintát szabad veni!
- ha beállt a termikus hőmérséklet és a forr.pont már nem változik - nagyítóval ell. - akkor azt feljegyezzük, a jobb oldali üvegcső lehajtásával mintát cseppemtünk - gőz, majd a bal oldali cseppentővel is mintát veszünk - folyadék
- a készüléknek minden forr. pont meghatározás után 1-2 percig hülnie kell, majd szétszedjük, maradék elegyünket kiöntjük, megvárjuk amíg megszárad, és a következő mintával folytatjuk
- (lassan forrnak fel a minták, így aforralás ideje alatt va idő megmérni a törésmutatókat: folyadé és gáz)
kiértékelés
- móltörtek kiszámítása: nA = sűrűségA * VA/MA és xA/nA+nB képletekkel
grafikonok
- saját törésmutató adatok fv-ében a móltört adatok ábrázolása (tiszta anyag is), plusz a kiegészítésben szereplő adatok - id is külön móltörteket kell számolni
- az első grafikonról leolvassuk az áltaunk mért törésmutatókhoz tartozó móltörteket: gőz törésmutatóhoz tartozó móltört (x) és folyadék törésmutatóhoz tartozó móltört (y)
- a felírt móltörtek függvényében ábrázoljuk a korrigált forráspontokat (kiegészítő lapon mérőhelytől függő kalibráció) és itt is ábrázolni kell a már megadott adatokat is: kiegészítő táblázat (szintén korrigálni kell a forr. pontokat)
9
Acetilszalicilsav vizes hidrolízisének vizsgálata
a mérés célja
A Kalmopyrin hidrolízis sebességi együtthatójának meghatározása 3-4 különböző hőmérsékleten a 40-70 oC tartományban. Lineáris extrapolációval meghatározzuk a szobahőmérséklethez (20oC)tartozó sebességi együttható értékét.
mérendő adatok
- abszorbancia
a mérés menete
- Előkészület
- termosztálás
- lombikok behűtése
- Mintakészítés
- a pormintát feloldjuk (15')
- lúgos hidrolízis összeállítása (reakcióidő: 40')
- Mintavétel
- 10 percenként a táblázatból leolvasott mennyiségű mintát veszünk. Ezt az előre lehűtött FeCl3 és desztvíz tartalmú lombikba teszem, 2-3'-ig még hűtöm (ha zavaros, savanyítom) és jelre töltöm!
- Fotometrálás
- 530 nm-en megmérjük az abszorbanciát (1 cm rétegvastagság)
számolás
- k=1/t*ln(A0*Vh/A0*Vh-A*Vh) egyenlet alapján 3 k-t számolunk, átlagoljuk
- saját és a mérőpárok eredményei alapján ln k vs 1/T fv-t megrajzoljuk az ln k = ln A-ΔrE/RT alapján.
eredmények
jegyzőkönyvhöz csatolva
kiegészítések alapján számolás és kiértékelés
- a képlet, amivel számolni kell: k: 1/t*ln(A0/A0-A*Vh/Vh'*Vth/Vm*Vreac/Vbem)
ahol
- Vh' = 250 v 500 cm3 - fotmetreáláshoz teljes hidrolízisminta tf-a;
- Vh = 25 cm3 - fotmetráláshoz hígított vizes hidtr. minta tf-a;
- Vth = 1 cm3 - hidloízishez vett minta tf-a;
- Vm = 2 v 5 cm3 - hidrolízis során vettminta tf-a;
- Vreac = 30 cm3 - mérés kezdetén a hidr. reakcióelegyének teljes tf-a;
- Vbem = 10 cm3 - hidr.-hez bemért törzso. tf-a;
az szorzó tag értéke:
- 55-60°C-nál: 0,06 : 10'-nél és 20'-nél; 0,15: 30'-nél és 40'-nél
- 40-45°C-nál: 0,03 (az összes mérésnél)
adatok az ábrázoláshoz
- X tg: 1/T skála, (termosztátok hőmérsékletének átszámolása kelvinbe: +273,15); a skála maximuma T = 293,15 K (20 °C) → 1/T = 0,003411 1/K legyen !!!; a minimum a saját méréstől függ, a legmagasabb hőmérsékletű termosztát kelvinbe átszámolt 1/T-je
- Y tg: a kiszámolt k értékekből ln-t vonunk, és ezeket ábrázuljuk
- így 12 pontot kapunk (3*4 egymás felett), s ezekre kell egy db egyenest húzni - kiegészítés alapján, de ez lehetetlen :)
- DE: a 3 külön mérés 4-4 k érétkéből számolt átlagok ábrázolása - eredeti könyv - ⇒ erre a 3 pontra könyebb egyenest húzni, így kell extrapolálni, vagyis a távolabbi, maximumnak választott tengelyen (1/T értéken) leolvassuk a 20°C-hoz tartozó k értékét 1/perc v 1/óra egységben
eredményszámolás
t9/10 = 1/k*ln10/9 = 0,1054/k (me: óra v perc)
11
Gyenge savak disszociációs állandójának meghatározása
grafikonok
13
konduktometriás titrálás erős és gyenge savat tartalmazó oldatban
a mérés célja
erős és gyenge sav koncentrációjának meghatáozása egymás mellett
a mérés leírása
- mérőberendezés bekapcsolása, dátum és idő ellenörzése, beállítása és a programok indítása
- büretta feltöltése 0.1 M NaOH mérőoldattal
- konduktométer méréshatárának beállítása (1000 mS)
- 10 cm3 ismeretlen pipettázása a mérőedénybe, desztvízzel kiegészítem az elegyet, hogy az elektródot elfedje a víz
- konduktométer mutatókilengésének és kimenőjelének beállítása
- Mérés - programmal (mindig a büretta aktuális állását kell beírni)
- Értékelés, nyomtatás
a mérés során 3 szakaszt különíthetünk el:
- 1. szakasz: a vezetés csökken - az erős sav semlegesítősik
- 2. szakasz: vezetés kis mértékben nő - gyenges sav semlegesítősik, jól disszociáló só képződik
- 3. szakasz: vezetés a túltitrálás miatt nő
számolás
- első fogyásérték → erős sav koncentrációja
- második fogyásérték - első fogyásérték → gyenge sav koncentrációja
mérési eredmények megadása
mellékelve a jegyzőkönyvhöz
- a mérési eredményeket és a grafikont tartalmazó gyakorlaton kinyomtatott papír
- savak koncentrációjai
18
- a 18as mérés elméleti részeit a gyakorlaton értheted meg igazán az oktatóprogram segítségével
- a gyakorlat a leghálásabb fizkém laborgyakorlat, ha kicsit figyelsz, szinte biztos az 5ös :)
- zh kérdések a témához
- Milyen állapotokat gerjeszt az IR és a mikrohullámú elektromágneses sugárzás és kb. mekkora a hullámhossz-tartományuk? Rendezze az elektromágneses sugárzásokat hullámhosszuk szerinti növekvő sorrendbe!
- Mi a normálrezgés és hány db normálrezgés, illetve valódi normálrezgés van egy N-atomos lieáris és nem lineáris molekula esetén? Milyen csoportokba szokás a normálrezgéseket sorolni? A rezgések közül melyek infra- és melyek Raman-aktívak?
- IR klasszikus spektrofotométerek elvi felépítése (sematikus rajz a részegységek megnevezésével). Írja le részletesen azt is, hogy mi a funkciója az egyes részeknek! MIért nem lehet üvegből készíteni a prizmát és a mintatatrtó küvettákat?
- Hogyan lehet kvalitatív és kvantitatív analízist végezni IR speltroszkópia segítségével? Melyik törvény segítségével végzünk kvantitatív elemzést (egyenet formájában)? Nevezze meg a törvényben szereplő mennyiségeket!
- Rajzolja fel sematikusan a harmonikus oszcillátor potenciális energia-kitérés (összenyomás vagy kihúzás) diagramját! Írja fel a potenciális energiát és frekvenciát egyenlet formájában!
19
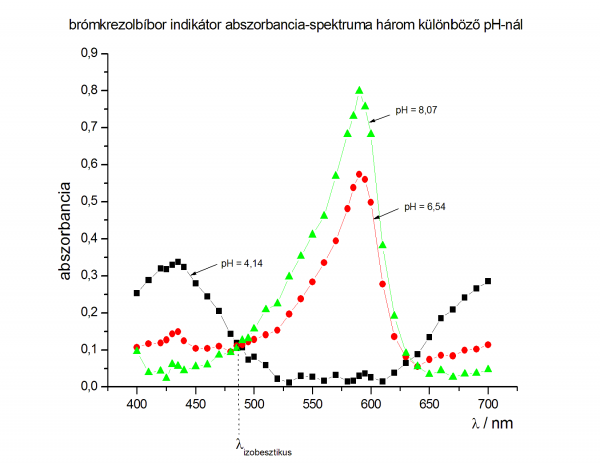
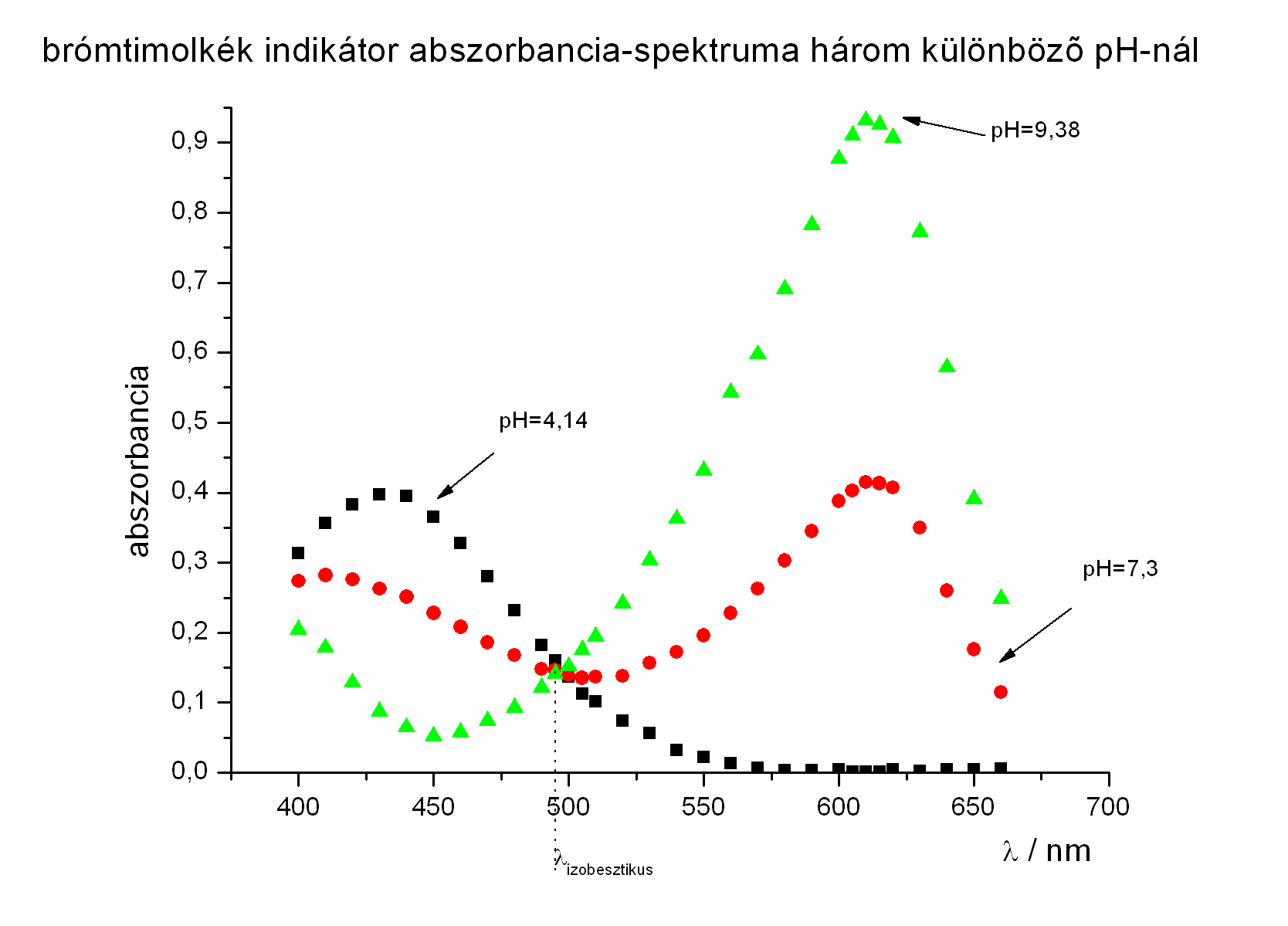
- brómkrezolbíbor spektruma (lehet, hogy nem szabad összekötni a pontokat, hanem görbét kell rá illeszteni)
- példa számolás brómkrezolbíborra:
- a spektrumról leolvasott értékek:
- az első max: 485 nm
- a második max: 590 nm
- az izobesztikus pont hullámhossza: 487 nm
- pKs értékek meghatározása a második maximumnál:
- pKs = pH - lg [(A-AHA)/(AA--A)]
- minden abszorbanciát a második maximumnál kell leolvasni
- 2. pufferoldat esetén (pH=5,91)
- pKs = 5,91 - lg [(0,293-0,030)/(0,799-0,293)] = 6,19
- 3. pufferoldat esetén (pH=6,54)
- pKs = 6,54 - lg [(0,574-0,030)/(0,799-0,574)] = 6,16
- 4. pufferoldat esetén (pH=6,74)
- pKs = 6,74 - lg [(0,646-0,030)/(0,799-0,646)] = 6,14
- a pKs értékek átlaga így:
- pKs = 6,16
23a
sók oldáshőjének meghatározása anizoterm kaloriméterrel
a mérés célja
ekvimoláris mennyiségű kristályvízmentes és kristályvíztartalmú Na-acetát oldáshőjének meghatározása anizoterm kaloriméterrel, a kapott értékek alapján a só hidratációhőjének meghatározása
a mérés leírása
- mintatartó cső bedugaszolása és paraffinozása a szivárgásmentes illeszkedés érdekében
- Dewar-edénybe 400 cm3 desztillált vizet töltünk
- az edénybe behelyezzük a keverőbabát, a hőmérőt és a kalorifert
- adott mennyiségű sót mérünk az edénybe (ekvimoláris mennyiségek)
- a Dewar-edénybe behelyezzük a mintatartót és az üvegbotot
- 5 percig magára hagyjuk a rendszert, hogy beálljon a hőmérsékleti egyensúly
- 20 másodpercenként észleljük a hőmérsékleteket, az eredményeket rögzítjük
- első előszakasz: 5-7 azonos érték leolvasásáig tart
- első főszakasz: bekapcsoljuk a kalorifert és adott ideig fűtjük vele a rendszert
- első utószakasz: a fűtés kikapcsolása után addig tart, amíg 5-7 azonos értéket nem észlelünk
- második főszakasz: üvegbottal kinyomjuk a mintatartó alját, így bejuttatjuk a sót. a bejuttatás és a teljes föloldódás időtartama a második főszakasz
- második főszaksz utószakasza: a só teljes föloldódása után addig mérjük a hőmérsékletet, amíg 5-7 azonos értéket nem kapunk
kiértékelés, számolás
- a hőmérséklet - idő értékpárok külön grafikonon ábrázolva
- a fűtés során végzett elektromos munka
- W = ( U2 / R ) * t
- ahol U a fűtőfeszültség (V), R a kalorifer ellenállása (Ω), t a fűtés időtartama (s) és W a munka (J)
- a hőmérsékletváltozások a grafikonokról leolvasva (ΔℑFSZ1 és ΔℑFSZ2)
- a kaloriméter hőkapacitása az összes tartozékkal együtt
- Cösszes = W / ΔℑFSZ1
- ahol C a hőkapacitás (J/°C)
- a kaloriméter hőkapacitása a betöltött víz nélkül
- Cegyéb = Cösszes - mvíz * cvíz
- ahol m a bemért víz tömege (g) és cvíz = 4,185 J/g°C
- második főszakaszban fölszabaduló/elnyelődő hő
- Q = - Cösszes * Δℑi
- ahol Q a hő (J)
- ebből a só oldáshője
- ΔrH = Q / nsó
- ahol ΔrH az oldáshő (J/mol), nsó pedig az anyagmennyiség (mol)
mérési eredmények megadása
- bemérés (g), 4 értékes jegy
- bemérés (mol), 5 értékes jegy
- kaloriméter hőkapacitása vízzel (J/°C), két tizedesjegy
- kaloriméter hőkapacitása víz nélkül (J/°C), két tizedesjegy
- az össz hőkapacitások átlaga (J/°C), két tizedesjegy
- számított oldáshők (J/mol), 5 értékes jegy
hidratációhő számítása
- a Na-acetát hidratációhője Hess tétele alapján a vízmentes só oldáshője - a víztartalmú só oldáshője
- ΔrH3 = ΔrH1 - ΔrH2
- mértékegysége kJ/mol, négy értékes jegy pontossággal
- negatív érték (pl. -33,82 kJ/mol)
mellékelve a jegyzőkönyvhöz
- külön grafiokon a vízmentes és a víztartalmú Na-acetát oldása közben bekövetkező hőmérsékletváltozásról az idő függvényében
- két mérési adatlap